希罗达
希罗达是胃肠道肿瘤患者的新希望,用于联合化疗治疗晚期或转移性结直肠癌、晚期或转移性胃癌
。
希罗达也适用于紫杉醇和化疗方案治疗无效的晚期原发性或转移性乳腺癌的进一步治疗。
目录 |
分类及成分
【分类】:乙类
【治疗分类】:化学治疗
【活性成分】:卡培他滨
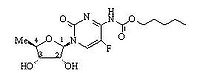
【 化学名称】:5’-脱氧-5-氟-N-[(戊氧基)羰基]-胞(嘧啶核)苷
【 化学结构式】:
【分子 式】:C15H22FN3O6
【分子 量】:359.35
【性状】: 0.15g:双凸、长方形、浅桃色包衣片,除去包衣后显白色。一面有XELODA字样,另一面有
150字样;0.5g:双凸、长方形、桃色包衣片,除去包衣后显白色。一面有XELODA字样,另一面有500字样。
适 应 证
结肠癌辅助化疗:卡培他滨适用于Dukes’ C期、原发肿瘤根治术后、适于接受氟嘧啶类药物单独治疗的结肠癌患者的单药辅助治疗。其治疗的无病生存期(DFS)不亚于5-氟尿嘧啶和甲酰四氢叶酸联合方案(5-FU/LV) 。卡培他滨单药或与其他药物联合化疗均不能延长总生存期(OS),但已有试验数据表明在联合化疗方案中卡培他滨可较5-FU/LV改善无病生存期。医师在开具处方使用卡培他滨单药对Dukes’ C期结肠癌进行辅助治疗时,可参考以上研究结果。用于支持该适应症的数据来自国外临床研究(见[临床试验]部分内容)。
结直肠癌:当转移性结直肠癌患者首选单用氟嘧啶类药物治疗时,卡培他滨可用作一线化疗。卡培他滨与其他药物联合化疗时,生存期优于5-FU/LV单药化疗。目前尚无证据证实卡培他滨单药化疗的生存期优势。有关卡培他滨在联合化疗中取代5-FU/LV的安全性以及生存期优势还需进一步研究。
乳腺癌联合化疗:卡培他滨可与多西紫杉醇联合用于治疗含蒽环类药物方案化疗失败的转移性乳腺癌。
乳腺癌单药化疗:卡培他滨亦可单独用于治疗对紫杉醇及含蒽环类药物化疗方案均耐药或对紫杉醇耐药和不能再使用蒽环类药物治疗(例如已经接受了累积剂量400 mg/m阿霉素或阿霉素同类物)的转移性乳腺癌患者。耐药的定义为治疗期间疾病继续进展(有或无初始缓解),或完成含有蒽环类药物的辅助化疗后6个月内复发。
胃癌:卡培他滨适用于不能手术的晚期或者转移性胃癌的一线治疗。
规格
(1) 0.15g; (2)0.5g
剂量与用法
推荐剂量
每日,500mg/m2,连用两周,休息一周。每日总剂量分早晚两次于饭后半小时用水吞服。如病情继续恶化或产生不能耐受的毒性时应停止治疗。
治疗中剂量调整
参考地址http://192.168.1.110/xld/index.html
希罗达所引起的毒性有时需要做对症处理或对剂量进行调整(停药或减量)。一旦减量,以后不能再增加剂量。以下是对毒性进行剂量调整时的推荐剂量(根据加拿大国家癌症研究所制定的常见毒性标准)。
1级。
2级。
第一次出现:停止治疗,直到恢复至0-1级水平时,按维持剂量的100%进行下一疗程治疗。
第二次出现:停止治疗,直到恢复至0-1级水平时,按维持剂量的75%进行下一疗程治疗。
第三次出现:停止治疗,直到恢复至0-1级水平时,按维持剂量的50%进行下一疗程治疗。
第四次出现:永久停止治疗。
3级:
第一次出现:停止治疗,直到恢复至0-1级水平时,按维持剂量的75%进行下一疗程治疗。
第二次出现:停止治疗,直到恢复至0-1级水平时,按维持剂量的50%进行下一疗程治疗。
第三次出现:永久停止治疗。
4级:
永久停止治疗。
如停药后需继续治疗,则应考虑到病人的最大益处,且在毒性症状恢复至0-1级水平时以推荐剂量的50%进行使用。
特殊人群的剂量调整
肝功能不全:对肝转移引起的轻度至中度肝功能不全的病人所进行的希罗达药代动力学研究表明,无需对这类病人做剂量调整。
肾功能不全:尚未对肾功能不全者(指血清肌酐)进行希罗达药代动力学研究。
儿童:尚未在儿童中进行希罗达的疗效与安全性研究。 老年人:无须作剂量调整。但在老年人(65岁以上)比年轻人更易对卡培他滨产生毒性,故应对其进行密切监测。
禁忌症
有希罗达严重副反应或对氟脲嘧啶(卡培他滨的代谢产物)有过敏史者禁用。
预防措施
需限制剂量的毒性包括:腹泻、腹痛、恶心、胃炎及手足综合征。近半数接受希罗达治疗者会诱发腹泻,对发生脱水的严重腹泻者应严密监测并给予补液治疗。每日腹泻4-6次或者夜间腹泻者为2级腹泻,每日腹泻7-9次或大便失禁和吸收障碍者为3级腹泻,每日腹泻10次以上或有肉眼血便和需静脉补液者为4级腹泻。如发生2、3或4级腹泻,则应停用希罗达,直到腹泻停止或腹泻次数减少到1级时再恢复使用。3级或4级腹泻后再使用希罗达应减少用量。几乎近一半使用希罗达的病人发生手足综合征,但多为1-2级,3级综合征者不多见。多数副反应可以消失,尽管需要暂时停止用药或减少用量,但无须长期停止治疗。
妊娠及哺乳妇女
尚未在妊娠妇女中进行希罗达临床研究,但必须要考虑到如果在这类病人中使用希罗达,可能会引起胎儿损伤。动物实验表明卡培他滨能导致胎儿死亡或畸形。这些发现预示卡培他滨衍生物也具有这种作用,因此不能在妊娠妇女中使用希罗达。如在妊娠期间使用希罗达,或在使用希罗达期间发生妊娠时,必须考虑到该药对胎儿损伤或致畸的潜在危险性。生育期妇女使用希罗达时必须采取避孕措施。
尽管尚不知希罗达是否能分泌于奶液中,但由于许多药物能在奶液中分泌而有对哺乳的婴儿造成严重副反应的潜在危险性,因此建议使用希罗达的妇女停止授乳。
副反应
希罗达的副反应较少,以下情况可能与之有关:
消化系统:希罗达最常见的副反应为可逆性胃肠道反应,如腹泻、恶心、呕吐、腹痛、胃炎等。
严重的(3-4级)副反应相对少见。
皮肤:在几乎一半使用希罗达的病人中发生手足综合征:表现为麻木、感觉迟钝、感觉异常、麻刺感、无痛感或疼痛感,皮肤肿胀或红斑,脱屑、水泡或严重的疼痛。皮炎和脱发较常见,但严重者很少见。
一般不良反应:常有疲乏但严重者极少见。其他常见的副反应为粘膜炎、发热、虚弱、嗜睡等,但均不严重。
神经系统:头痛、感觉异常、味觉障碍、眩晕、失眠等较常见,但严重者少见。
心血管系统:下肢水肿较轻且不常见。尚未见其他心血管系统副作用。
血液系统:中性粒细胞减少且少见也不严重,贫血极少见也不严重。
其他:厌食及脱水常见,但重者极少见。
相互作用
联合用药:希罗达与大量药物合用,如抗组胺药,NSAIDs,吗啡,扑热息痛,阿斯匹林,止吐药,H2受体拮抗剂等,未见具有临床意义的副作用。
蛋白结合:卡培他滨与血清蛋白结合率较低(64%)通过置换与能蛋白紧密结合的药物发生相互作用的可能性尚无法预测。
与细胞色素P450酶间的相互作用:在体外实验中,未发现卡培他滨对人类肝微粒体P450酶产生影响。
药理毒理
药理作用
正常细胞和肿瘤细胞都能将5-FU代谢为5-氟-2-脱氧尿苷酸单磷酸(FdUMP)和5-氟尿苷三磷酸(FUTP)。这些代谢产物通过二种不同机制引起细胞损伤。首先,FdUMP及叶酸协同因子N5,10-亚甲基四氢叶酸与胸苷酸合成酶(TS)结合形成共价结合的三重复合物。这种结合抑制2’- 脱氧尿[嘧啶核]苷酸形成胸核苷酸。胸核苷酸是胸腺嘧啶核苷三磷酸必需的前体,而后者是DNA合成所必需的,因此该化合物的不足能抑制细胞分裂。其次,在RNA合成过程中核转录酶可能会在尿苷三磷酸(UTP)的部位错误地编入FUTP。这种代谢错误将会干扰RNA的加工处理和蛋白质的合成。
毒理研究
目前尚无足够多的研究评价卡培他滨的致癌性。卡培他滨在体外不引起细菌(Ames试验)或哺乳动物细胞(中国仓鼠V79/HPRT基因突变分析)突变。卡培他滨在体外对人外周血淋巴细胞有致断裂作用,而在小鼠骨髓活体内(微核试验)却无致断裂作用。氟尿嘧啶引起细菌和酵母的突变,还在小鼠体内的微核试验中引起染色体异常。
在小鼠的生育能力和总繁殖表现的研究中,口服卡培他滨760mg/kg/天扰乱了发情期并导致生育能力下降。在妊娠小鼠中,此剂量下无胚胎存活。发情期的扰乱是可逆的。该剂量在这个试验中引起了雄性的退化改变,包括精母细胞和精子细胞数目的减少。单独的药代动力学研究显示,对应于小鼠该5’-DFUR AUC值的剂量大约是患者每日建议剂量的0.7倍。
药物过量
希罗达的临床试验中,未发现由于药物过量而引起的副反应。但动物实验(对猴类以25,679mg/m2/天的积极治疗)以及对人以最大耐受剂量(3,514mg/m2/天)治疗中,药物过量的表现为恶心、呕吐、腹泻、胃肠激惹、肠胃出血和骨髓抑制等。处理方法应包括使用利尿剂脱水治疗,必要时透析治疗。
保存方式
药品应置於摄氏 15 ~ 25 度干燥处所;如发生变质或过期,不可再食用。
包装
铝塑包装
0.15g:30片/盒,60片/盒
0.5g:12片/盒,60片/盒
有效期
24个月。
执行标准
YBH08582008
批准文号
0.15g:国药准字H20073023
0.5g:国药准字H20073024