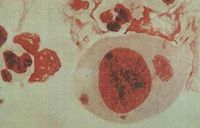
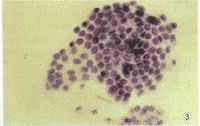
包涵体
包涵体即表达外源基因的宿主细胞,可以是原核细胞,如大肠杆菌;也可以是真核细胞,如酵母细胞、哺乳动物细胞等。包涵体是病毒在增殖的过程中,常使寄主细胞内形成一种蛋白质性质的病变结构,在光学显微镜下可见。多为圆形、卵圆形或不定形。一般是由完整的病毒颗粒或尚未装配的病毒亚基聚集而成;少数则是宿主细胞对病毒感染的反应产物,不含病毒粒子。
目录 |
简介
包涵体(inclusion body)
基因工程定义:在某些生长条件下,大肠杆菌能积累某种特殊的生物大分子
,它们致密地集聚在细胞内,或被膜包裹或形成无膜裸露结构,这种水不溶性的结构称为包涵体(Inclusion Bodies,IB)。
病毒在增殖的过程中,常使寄主细胞内形成一种蛋白质性质的病变结构,在光学显微镜下可见。多为圆形、卵圆形或不定形。一般是由完整的病毒颗粒或尚未装配的病毒亚基聚集而成;少数则是宿主细胞对病毒感染的反应产物,不含病毒粒子。有的位于细胞质中(如天花病毒包涵体),有的位于细胞核中(如疱疹病毒),或细胞质、细胞核中都有(如麻疹病毒)。有的还具有特殊名称,如天花病毒包涵体叫顾氏(Guarnieri)小体,狂犬病毒包涵体叫内基氏(Vegri)小体。昆虫病毒可根据包涵体的形状、位置而分为细胞质型多角体病毒、核型多角及颗粒体病毒等。
组成与特性
RNA聚合酶、外膜蛋白ompC、ompF和ompA等,环状或缺口的质粒DNA,以及脂体、脂多糖等,大小为0.5-1um,难溶与水,只溶于变性剂如尿素、盐酸胍等。
形成
主要因为在重组蛋白的表达过程中缺乏某些蛋白质折叠的辅助因子或环境不适,无法形成正确的次级键等原因形成的。
1、表达量过高,研究发现在低表达时很少形成包涵体,表达量越高越容易形成包涵体。原因可能是合成速度太快,以至于没有足够的时间进行折叠,二硫键不能正确的配对,过多的蛋白
间的非特异性结合,蛋白质无法达到足够的溶解度等。
2、重组蛋白的氨基酸组成:一般说含硫氨基酸越多越易形成包涵体,而脯氨酸的含量明显与包涵体的形成呈正相关。
3、重组蛋白所处的环境:发酵温度高或胞内pH接近蛋白的等电点时容易形成包涵体。
4、重组蛋白是大肠杆菌的异源蛋白,由于缺乏真核生物中翻译后修饰所需酶类,致使中间体大量积累,容易形成包涵体沉淀。因此有人采用共表达分子伴侣的方法以增加可溶蛋白的比例。
在基因重组技术得到迅速发展之前,研究者就已经发现,细胞内人工引入反常的蛋白质(这些蛋白质可以看作是细胞的外源蛋白质),这些蛋白质会堆积起来形成不溶的形式。这些蛋白质聚集的形态是明显的球形,这些球形的物质全部是蛋白质,并且通过非共价键的作用力形成,必须使用变性剂如十二烷基硫酸钠(SDS)或者盐酸胍才能溶解。自从基因工程的蛋白质在大肠杆菌表达以后,人们逐渐发现这些外源蛋白质基因在细胞中的过量表达同样形成不溶性的状态。
Georgiou等人发现天然的蛋白质在大肠杆菌中大量表达时,如内酰氨酶和碱性磷酸酶的过量表达,都形成了包涵体,前者的包涵体在外周质,后者的包涵体存在于细胞质中。其它的宿主细胞中也发现了重组蛋白质过量表达时形成的包涵体或者聚集体,如细菌病毒、哺乳动物细胞中。
包涵体在一些外界压力下也可以形成,如温度,是影响包涵体形成与否的主要因素。有些蛋白质在高温的情况下容易形成包涵体,这是由于这些蛋白质在高温下容易变性而形成聚集体。所以有人认为,当蛋白质具有高的融化温度、高的天然构象稳定性的情况下,包涵体就不容易形成。但是,对一些体内包涵体形成的研究发现,包涵体的形成先于成熟肽链的形成,或者是同时进行的。在研究P22尾刺蛋白质发现,尽管尾刺蛋白质有高的稳定性,结构中主要是片断,融化的温度是88℃,并不受SDS、蛋白质酶和热失活的作用,但是这种蛋白质是为数不多的在细胞内形成包涵体的原核蛋白质模型。有些天然的蛋白质在高温(391℃
)表达时可以提高25%,但是这些蛋白质不能折叠成天然的状态而形成聚集体。聚集体形成的动力学表明,这些聚集体是从部分折叠的中间体形成的。实际上,这些折叠的中间体或者形成天然的状态,或者形成聚集体,这个过程是温度依赖性的,温度的升高利于聚集体的形成。当蛋白质肽链在高温下表达,合成的肽链足够早地转移到低温下时,这些蛋白质肽链会重新进入折叠的过程。同时,当尾刺蛋白质在允许的温度下表达后,再把细胞转移到高温下,这些蛋白质肽链保持活性,证明了一旦蛋白质被正确的表达并折叠成正确的构象以后,则细胞内的蛋白质的稳定性和溶解性在高温下不再改变。蛋白质在体内折叠的中间体对于温度因子明显敏感。
沙眼衣原体包涵体最近认为较高的温度可能增加了蛋白质合成的速度、折叠中间体形成聚集体的速度以及疏水相互作用力,表达的蛋白质易于以包涵体的形式存在。
其它的发酵条件同样影响蛋白质包涵体的形成,发酵液中加入蔗糖可以大大降低内酰胺酶包涵体的形成。蔗糖的作用可能是稳定天然蛋白质的结构或者防止蛋白质折叠中间体的聚集。在体外的内酰胺酶折叠复性的过程中,同样发现复性缓冲液中加入蔗糖可以提高蛋白质的复性率。其它促重组蛋白质可溶性表达的生长添加剂还有乙醇(诱导热休克蛋白质的表达)、低分子量的巯基或二硫化合物(影响细胞周质的还原态,从而影响二硫键的形成)和NaCl。也有报道认为在丰富的培养基中有利于活性蛋白质的表达,当培养条件不佳时如供氧不足或pH控制不佳时易形成包涵体。
蛋白质的聚集体和包涵体不仅仅存在于重组蛋白质的表达中,是一个广泛存在的现象。通常认为,蛋白质的聚集现象,无论细胞内还是细胞外,都是中间体不能完成折叠而形成自我聚集现象。包涵体的形成与多肽链的序列、表达速度、可用的伴侣分子的量以及生长的环境有关。
特点
包涵体是新合成的肽链在折叠过程中部分折叠的中间体形成的,而不是由完全的解折叠形式的蛋白质形成的,这可能与体外复性时聚集体的形成有相似的机制,
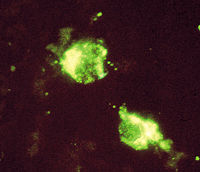
包涵体荧光图
应该考虑到在包涵体中含有这些部分折叠的结构。但是,由于包涵体的特性,很难利用物理的方法去探测包涵体中蛋白质肽链的结构。 Zetlmeissl等人利用圆二色的方法,发现聚集体的肽链保持了部分的二级结构。利用Raman测定的方法也得出了相同的结论。利用ATR-FTIR发现包涵体蛋白质的结构比天然的蛋白质和盐沉淀的蛋白质含有更多的非天然状态的折叠的结构。Murry等人利用免疫学的方法测定色氨酸合成酶的亚基,蛋白质复性以后,出现三种形式的蛋白质:一种是不溶的高分子量的聚集体,一种是可溶的复性完全的蛋白质,一种是可溶的低分子量的聚集体,最后一种聚集体同天然的蛋白质一样有免疫活性,可以与两种单克隆抗体结合,但是天然蛋白质的另外三种抗体不与它结合,说明了即使没有复性,聚集体仍保持了部分的近似天然的结构状态。
在大肠杆菌中,包涵体可以在细胞的两个位置出现:细胞质和外周胞质。包涵体在细胞内形成的位置和特点取决于蛋白质表达的方式。三种表达的内酰氨酶,一种是天然的内酰氨酶,一种是含有OmpA信号肽,一种完全切除了天然蛋白质的信号肤,当大量表达时,造成了聚集体的形成,前两者的聚集体在外周胞质,后者在细胞质内形成聚集。这些包涵体在大小和形状有相当清楚的差别,这些差别表现了聚集体的表面形态、组成和形成聚集体的多肽链构象上的不同。
大肠杆菌细胞质中的包涵体直径一般在0.2到1.5μm之间,不同的蛋白质具有不同的直径,如干扰素的大小是0.811μm,而牛凝乳酶原的大小是1.281μm。大的包涵体可以利用光学显微镜看得到。在一些情况下,有些包涵体比较大,直径大于大肠杆菌的直径,使得大肠杆菌有一个突起。一般情况下,一个细胞仅有一个包涵体。包涵体从来不吸附在膜上,并且不同于真核细胞中的其它的细胞器。高精度的投射电子显微镜显示了多孔的结构。
所有的包涵体密度较大,是微生物细胞中密度最大的结构,密度在1.1-1.3之间,不同蛋白质的包涵体的密度也不同,一些低分子量的包涵体结构是多孔的。
聚集体的构象还没有进行系统的研究,但是已经知道聚集在一起的作用力不是共价键,主要的是疏水相互作用力。大肠杆菌的细胞质中有大量的谷胱甘肽,抑制二硫键的形成。所以,当蛋白质在细胞质中表达时,由于形成不了二硫键而形成了聚集体。内酰氨酶的包涵体进行蔗糖梯度离心表明其中95%是蛋白质成分,说明很少有其他的蛋白质成分加入到聚集体中,利用免疫学的方法,也没有发现伴侣分子。体内聚集体的形成不仅产生包涵体,而且会带来淀粉质的疾病,对哺乳动物同样会造成疾病。
对体内或者体外蛋白质聚集体形成的研究,特别是了解氨基酸序列如何避免聚集体的形成,可以大大提高蛋白质在体外折叠的收率,并且有助于理解体内分子病形成的机制。
病毒包涵体
包涵体有的位于细胞质中(如天花病毒包涵体),有的位于细胞核中(如疱疹病毒),或细胞质、细胞核中都有(如麻疹病毒)。
有的包涵体还具有特殊名称,如天花病毒包涵体叫顾氏(Guarnieri)小体,狂犬病毒包涵体叫内基氏(Vegri)小体。昆虫病毒可根据包涵体的形状、位置而分为细胞质型多角体病毒、核型多角及颗粒体病毒等。
分离
一旦一个稳定的、重复的发酵过程建立起来,则要考虑提取包涵体的步骤了。包涵体处在细胞质内或者细胞的外周质,必须破坏细胞膜才能把包涵体释放出来。
溶液中的包涵体也要同破碎液中溶解的成分和不溶的其它成分如细胞碎片、细胞膜以及核糖体等成分分离开来。 提取的第一步是冷却发酵液,利用离心或者错流过滤的方法收集细胞,细胞的沉淀利用设定的含有一定浓度的离子强度(0.4-0.6mo1)的缓冲液悬浮。这种缓冲液必须控制pH、离子强度、重金属的浓度和氧化还原的环境,在以后的操作步骤中也要考虑这些因素。
由于包涵体比细胞可以耐受更大的剪切力,所以可以使用的破碎细胞的方法有很多。对于大肠杆菌,最经常使用的方法是高压匀浆的方法,可以使细胞完全破碎,并且这种方法可以以不同的规模使用,2到5个循环可以使细胞完全破碎。酵母细胞由于含有更加有弹力的细胞壁,所以需要的循环可能更多,或者在容器中加入一些玻璃颗粒。破碎细胞还可以使用物理的方法如超声,或者化学的方法如化学试剂和酶,如溶菌酶和EDTA(乙二胺四乙酸)来破碎细胞。
包涵体可以使用过滤或者离心的方法,把细胞破碎液中的其它成分除去,这两种方法利用了包涵体的不同物理特性。由于包涵体和可溶蛋白质的体积不同,所以可以使用过滤的方法,这种方法可以降低操作成本,易于放大。一些实验已经证明过滤的方法是分离包涵体的有效的手段,但是这种方法也存在着一些缺点:过滤膜很容易被一些不透过的成分所堵塞,即使使用错流过滤或者使用很高的流速,这种情况都不能避免。并且,由于微孔膜是根据成分的大小来分离的,一些细胞碎片也容易与包涵体混在一起。
而包涵体蛋白质的密度比相同体积的细胞碎片的密度大得多,所以使用离心的手段可以把包涵体与细胞的其它成分分离开来。如果细胞碎片没有同包涵体分离,在以后的分离手段中必须把膜上的组分分离开来。有时,有些目标蛋白质以溶解的形式存在,可以通过在细胞破碎以前加入一些非极性的物质(如苯酚、甲苯)或者去垢剂,通过这个方法可以提高从大肠杆菌表达的人生长激素包涵体的收率。
连续离心技术是工业生产中获得包涵体最经常使用的操作。由于细胞碎片的密度比包涵体小,则沉降的速度比包涵体要小,连续的悬浮、离心可以把大部分的包涵体离心下来,而细胞碎片逐步除去。SDS-PAGE(十二烷基硫酸钠-聚丙烯酞胺凝胶电泳)分析发现,离心的方法可以达到沉降物中的蛋白质的含量大于90%。
包涵体荧光图
当细胞碎片与包涵体混在一起难于分离时,可以采用一些化学的方法把细胞碎片离子交换色谱复性蛋白质与包涵体分离开,否则溶解包涵体以后,膜蛋白质溶在包涵体蛋白质的溶液中,会污染以后的操作。特别如果一些膜蛋白质具有蛋白质酶的活性,则溶解以后的包涵体蛋白质可被降解。如果溶解原核细胞膜蛋白质的一些溶剂不能溶解包涵体蛋白质时,可以使用溶解的方法把膜蛋白质除去。最经常的选择性溶解膜蛋白质的方法是利用鳌合金属的试剂如EDTA、中性的去垢剂如Triton X-100,或者一些盐如,脱氧胆酸盐,或者弱离液剂,如2mol/L的脲。Babbit等人发现经过前面的步骤,可以提高肌氨酸激酶的复性收率,活性提高的原因是使用弱的去垢剂辛基糖除去了蛋白质酶。
离心和高压匀浆都有可能产生泡沫,所以必须在工业规模中避免这种无谓的损失。有些工业生产中,分离以前在发酵罐中把细胞杀死使细胞内的物质释放出来,并同时溶解或者不溶解包涵体蛋白质。这种在线杀死细胞的方法己经用来生产两种蛋白质:在碱性条件下溶解类胰岛素生长因子和高温、酸性条件下生产重组的抗真菌肽段。这种方法的优点是可以节省操作时间以及能量消耗,仅仅需要一步离心的步骤。最经常使用的杀死细胞的试剂有苯乙醇,辛酸,氯仿,甲苯等。杀死细胞时也有缺点,溶解的目标蛋白质中含有蛋白质或者非蛋白质的物质,降低了蛋白质的纯度;如果目标蛋白质没有被溶解,则杀死细胞会使可溶蛋白质产生沉淀,使得包涵体的纯化比较困难,或者破坏包涵体内部的重组蛋白质。
溶解
维持包涵体内蛋白质结构的作用力是分子内的作用力,这种作用
力也维持天然蛋白质的稳定性的结构。先前有报道这种作用力是共价键结合的,但是,现在趋向于一致,就是维持包涵体内部的蛋白质的紧密的结构的是非共价键的作用力。二硫键,无论是正确的还是错误的二硫键,在维持内部蛋白质的紧密的结构中都没有发挥直接的作用。最经常的获得活性蛋白质的第一步是溶解这些包涵体蛋白质,溶解液是使这些包涵体蛋白质完全变性的成分,当蛋白质被溶解以后,则进入到蛋白质的体外折叠的过程。
包涵体溶解
遵循标准
包涵体蛋白质的溶解同样是一个工艺的关键的步骤。溶剂的选择会影响后续的操作、最终的各种蛋白质的收率以及最终的成本,必须遵循以下的标准:
(1) 快速溶解的动力学;
(2) 与蛋白质的结合是可逆的;
(3) 对细胞碎片的分离方法没有干扰作用;
(4) 对温度没有依赖作用;
(5) 抑制蛋白质酶的降解作用;
(6) 与蛋白质的氨基没有化学修饰作用;
(7) 在可能的情况下,选择最低的溶解浓度和廉价的溶剂,并适于以后的复性方法。
溶解包涵体
最经常使用溶解包涵体的试剂包括离液剂或者去垢剂。
最经常使用的溶解和制备蛋白质的离子型的离液剂最早
于1969年Hatefi等人发展的离子型的去垢剂如SDS是另外一种溶解包涵体蛋白质和膜蛋白质的试剂,但是一般不用来大规模的生产,而是用来定性。除了强酸、强碱和利用有机溶剂来提取疏水性很强的蛋白质以外,其他的变性方法如非可逆的共价修饰在工业的大规模生产中很少用到。一旦蛋白质被溶解,蛋白质中的巯基很容易快速地氧化并形成共价的聚集体或者分子内错配的二硫键,然后这些蛋白质就不能再进行折叠。为了防止氧化,可以使这些基团或者利用缓冲液中含有低分子量的疏基试剂保持在还原的状态或形成磺酸盐或者形成混合的二硫键。
去垢剂
去垢剂是一种最经济的溶解包涵体蛋白质的方法,一个最大的优点是溶解的蛋白质有可能保持全部的生物活性,说明在此条件下保持了蛋白质的四级结构。最重要的是稀释以后蛋白质的聚集比其它溶剂生成的很少。阳离子型、阴离子型的和非离子型的去垢剂都可以使用,使用时的浓度一般高于去垢剂的临界胶束浓度(CMC ),通常是0.5-5%。
SDS仅仅在大量生产牛生长激素、干扰素和白介素-2中用到。SDS由于具有较低的临界胶束浓度(CMC)而使得结合到蛋白质分子上的SDS比较难于除去。由于N-十二烷肌氨酸它的CMC比SDS高0.4%,也被用来溶解包涵体蛋白质并可用稀释的方法使蛋白质复性,残余的去垢剂可以使用阴离子交换色谱或者超滤的方法除去。这种去垢剂是一种比较温和的去垢剂,可以选择性地溶解一些包涵体,但是不能溶解完全的变性的蛋白质的聚集体和大肠杆菌的内膜的蛋白质分子。使用去垢剂一个主要的缺点是对以后的纯化和复性的步骤的干扰,去垢剂结合到蛋白质上的强度大离子交换色谱复性蛋白质小不同,比较难于除去,并干扰离子交换和疏水相互作用色谱的过程,在变性的浓度时超滤膜会吸附这些变性剂。所以复性后需要尽量洗涤这些去垢剂,也可以使用环状糊精链状糊精或者环状淀粉从复性缓冲液中提取去垢剂。
一个不容忽视的问题是去垢剂可以溶解全部的膜蛋白质中的蛋白质酶,这些蛋白质酶的活性在去垢剂的存在的情况下被活化,可能造成溶解和复性过程的收率的降低。蛋白质复性的收率可以通过以下的方法来提高:
a) 先期使用可以溶解膜蛋白质但是不溶解包涵体蛋白质的溶剂尽量洗涤包涵体蛋白质;
b) 包涵体的含有的菌体碎片被完全除去;
c) 溶解包涵体的液体中含有蛋白质酶的抑制剂,如EDTA,苯甲基磺酰氟(PMSF )等 。
离液剂
其它的离液剂也被用来溶解包涵体蛋白质,最主要的溶解包涵体蛋白质的离液剂是盐酸胍和尿素,这是最经常使用的溶解试剂,一般情况下选择6-8mo1/L的浓度,蛋白
质浓度在1-10mg/mL。
在溶解色氨酸合成酶A的过程,发现阳离子的溶解能力顺序是Gdm+ > Li+ > K+ > Na+,阴离子的顺序是SCN- > I- > Br- >Cr-。一些离液剂由于它们的溶液比盐酸胍和尿素有更高的密度和黏度而不适合用于溶解包涵体,因为利用离心和色谱分离起来比较困难。
为了溶解包涵体蛋白质需要的尿素或者盐酸胍的浓度根据蛋白质的不同而不同。如果蛋白质天然形态需要溶解的变性剂的浓度不能获得,则在溶解包涵体时需要首先确定离液剂的浓度。
大肠杆菌
盐酸胍由于比较贵,所以一般用来溶解一些附加值比较高的药物蛋白质分子,选择盐酸胍作为溶解试剂,是因为盐酸胍是一种比脲更为强烈的变性剂,甚至可以溶解脲所不能溶解的包涵体;尿素,由于可能被自发的形成的氰酸盐或者已有的氰酸盐的污染,特别是在碱性环境中,从而造成蛋白质的自由的氨基被不可逆的修饰。消除此种影响的方法是用阴离子的缓冲系统如Tris-HCl溶解脲或者脲在使用之前利用阴离子交换色谱纯化,并且配制的溶解和复性的缓冲液在当天使用。脲溶液中影响蛋白质变性的因素与盐酸胍的不同。溶在脲中的蛋白质受到pH和离子强度的影响,从而影响电荷的蛋白质残基之间的电荷作用,但是由于盐酸胍含有高浓度的离子强度,所以这两个因素的影响很少。
混合溶剂
一般情况下去垢剂并不联合使用,Lilly等人发现去垢剂和尿素的混合液有效的摩尔浓度较低。尿素和去垢剂型的盐混合可以使蛋白质变性,但是尿素和非去垢剂的盐如氯化钠反而降低包涵体蛋白质的溶解性,所以要避免使用。
去垢剂结合其他的试剂或者溶解增强剂也被使用,发现尿素和乙酸,尿素和二甲亚枫,尿素和高pH等是比较有效的溶解包涵体蛋白质的方法。
高压(1-2kbar)、超声也可以溶解包涵体蛋白质,此时使用的溶解试剂浓度可以比较低,便于后续的复性步骤。
极端pH
酸碱度也是比较廉价的有效的溶解包涵体的方法。最经常使用酸的是有机酸,浓度在5-80%之间。Gavif和Better使用低的(pH≤2.6)和高温(85℃ )溶解抗真菌的重组蛋白质的肤段,低温和高PH需要溶解时间要长。Reddy和合作者也使用20%乙酸溶解一种麦芽糖结合的蛋白质。但是,同样的一些不可逆的修饰作用或者酸降解会在极端pH下发生,所以此种方法并不是经常使用的溶解包涵体的方法。
高pH(≥12)也被用来溶解生长激素和原胰岛素。在高pH下一些蛋白质同样可能发生非可逆的变性,原因在于半胱氨酸在碱性条件下的脱硫过程。所以这种方法尽管比较简单、廉价,同样仅仅用于一些特定的蛋白质,特别对于药用蛋白质一般不采用这种方法。
有利因素
1、可溶性蛋白在细胞内容易受到蛋白酶的攻击,包涵体表达可以避免蛋白酶对外源蛋白的降解。
2、降低了胞内外源蛋白的浓度,有利于表达量的提高。
3、包涵体中杂蛋白含量较低,且只需要简单的低速离心就可以与可溶性蛋白分离,有利于分离纯化。
4、对机械搅拌和超声破碎不敏感,易于破壁,并与细胞膜碎片分离。
实验方法
破菌
1、机械破碎
2、超声破碎
3、化学方法破碎
洗涤
由于脂体及部分破碎的细胞膜及膜蛋白与包涵体粘连在一起
,在溶解包涵体之前要先洗涤包涵体,通常用低浓度的变性剂如2M尿素在50mM TrispH7.0-8.5左右,1mMEDTA中洗涤。此外可以用温和去垢剂TritonX-100洗涤去除膜碎片和膜蛋白。
去垢剂
如强的阴离子去垢剂SDS,可以破坏蛋白内的疏水键,可以增溶几乎所有的蛋白。问题是由于SDS无法彻底的去除而不允许在制药过程中使用。
极端pH
可以破坏蛋白的次级键从而增溶蛋白。如有人在pH>9.0溶解牛生长激素和牛凝乳蛋白酶包涵体。有些蛋白可以溶解在60mMHCl中。这些方法只适合于少部分蛋白的增溶。
变性剂的使用浓度和作用时间:一般在偏碱性性的环境中如pH8.0-9.0,尿素在碱性环境中不稳定,一般不要超过pH1.0。有些蛋白只能用盐酸胍如IL-4。增溶时一般室温过夜,但盐酸胍在37度小时便可以使多数蛋白完全变性溶解。
还原剂
由于蛋白间二硫键的存在,在增溶时一般使用还原剂。还原剂的使
用浓度一般是50-100mM2-BME或DTT,也有文献使用5mM浓度。在较粗放的条件下,可以使用5ml/l的浓度。还原剂的使用浓度与蛋白二硫键的数目无关,而有些没有二硫键的蛋白加不加还原剂无影响,如牛生长激素包涵体的增溶。对于目标蛋白没有二硫键某些包涵体的增溶,有时还原剂的使用也是必要的,可能由于含二硫键的杂蛋白影响了包涵体的溶解。
复性
通过缓慢去除变性剂使目标蛋白从变性的完全伸展状态恢复到正常的折叠结构,同时去除还原剂使二硫键正常形成。一般在尿素浓度4M左右时复性过程开始,到2M左右时结束。对于盐酸胍而言,可以从4M开始,到1.5M 时复性过程已经结束。
复性中常采用的方法有:
稀释复性:直接加入水或缓冲液,放置过夜,缺点是体积增加较大,变性剂稀释速度太快,不易控制。
透析复性:好处是不增加体积,通过逐渐降低外透液浓度来控制变性剂去除速度,有人称易形成沉淀,且不适合大规模操作,无法应用到生产规模。
超滤复性:在生产中较多的使用,规模较大,易于对透析速度进行控制,缺点是不适合样品量较少的情况,且有些蛋白可能在超滤过程中不可逆的变性。
柱上复性:是最近研究较多并成功的在生产中应用的一种复性方法,如华北制药的G-CSF复性据说是通过柱上复性进行的。常用于复性的层析方法有SEC、HIC等。
还原剂的去除
还原剂一般和变性剂的去除一起慢慢的氧化去除,使二硫键慢慢形成。但是由于二硫键的形成并不是蛋白质正确折叠所必须的,可以考虑在变性剂完全去除之后,在去除还原剂使已经按照正确的结构相互接近的巯基间形成正确的二硫键。
常用的氧化方法有:
空气氧化法:在碱性条件下通空气,或者加入二价铜离子,能够取得更好的效果,缺点是不易控制氧化还原电势。
氧化还原电对(redox):常采用GSSG/GSH,通过调整两者的比例来控制较精确的氧化还原电势,也可以在添加了还原剂如BME、DTT的增溶液中直接加入GSSG,如:5mMGSSG/2mM DTT=GSH/GSSG(1.33/1)。
复性的效率
复性是一个非常复杂的过程,除与蛋白质复性的过程控制相关外,还很大程度上与蛋白质本身的性质有关,有些蛋白非常容易复性,如牛胰RNA酶有12对二硫键,在较宽松的条件下复性效率可以达到95%以上,而有一些蛋白至今没有发现能够对其进行复性的方法如IL-11,很多蛋白
的复性效率只有百分之零点几。一般说来,蛋白质的复性效率在20%左右。影响复性效率的因素有蛋白质的复性浓度,变性剂的起始浓度和去除速度、温度、pH、氧化还原电势、离子强度、共溶剂和其他添加剂的存在与否等。
添加剂
1、共溶剂:如PEG6000-20000,据说可以可逆的修饰折叠中间体的疏水集团,此外由于阻止了蛋白质分子间的相互接触的机会,也可能对复性效率的提高起作用。一般的使用浓度在0.1%左右,具体条件可根据实验条件确定。
2、二硫键异构酶(PDI)和脯氨酸异构酶(PPI):PDI可以使错配的二硫键打开并重新组合,从而有利于恢复到正常的结构,此外在复性过程中蛋白质的脯氨酸两种构象间的转变需要较高能量,常常是复性过程中的限速步骤,而PPI的作用是促进两种构象间的转变,从而促进复性的进行。
3、分子伴侣,即热休克蛋白(HSP),是一种没有蛋白质特异性的促进折叠的蛋白因子,研究发现很多蛋白在缺乏分子伴侣时无法自己正确的折叠。有人构建了与伴侣分子共同表达的菌株,据说效果不错。不过在生产中还没有看到2和3的应用的例子。
4、0.4-0.6ML-Arg:成功的应用于很多蛋白如t-PA的复性中,可以抑制二聚体的形成。
5、甘油等:增加黏度,减少分子碰撞机会,一般使用浓度在%5-30%。
6、一定的盐浓度,可能是为了降低某些带电集团间的斥力,有利于蛋白质的折叠。
7、辅助因子:添加蛋白质活性状态必须的辅助因子如辅酶辅基等或蛋白配体等很多时候对蛋白质正确的折叠是有利的。
8、色谱法:通过将目标蛋白结合到层析柱上,减少蛋白分子间的相互影响,该方法得到越来越多的应用,常用的色谱有SEC、HIC、IEC、IMAC等。
当然,虽然有很多所谓的理性的复性方案设计,目前的复性工作更多的是一个经验的过程,没有一种通用的方法可以套用。
蛋白浓度
一般使用浓度为0.1-1mg/ml,太高的浓度容易形成聚体沉淀,太低的浓度不经济,而且很多蛋白在低浓度时不稳定,很容易变性。
检测
根据具体的蛋白性质和需要,可以从生化、免疫、物理性质等方面对蛋白质的复性效率进行检测。
1、凝胶电泳:一般可以用非变性的聚丙烯酰胺凝胶电泳可以检测变性和天然状态的蛋白质,或用非还原的聚丙烯酰胺电泳检测有二硫键的蛋白复性后二硫键的配对情况。
2、光谱学方法:可以用紫外差光谱、荧光光谱、圆二色性光谱(CD)等,利用两种状态下的光谱学特征进行复性情况的检测,但一般只用于复性研究中的过程检测。
3、色谱方法:如IEX、RP-HPLC、CE等,由于两种状态的蛋白色谱行为不同。
4、生物学活性及比活测定:一般用细胞方法或生化方法进行测定,较好的反映了复性蛋白的活性,值得注意的是,不同的测活方法测得的结果不同,而且常常不能完全反映体内活性。
5、黏度和浊度测定:复性后的蛋白溶解度增加,变性状态时由于疏水残基暴露,一般水溶性很差,大多形成可见的沉淀析出。
6、免疫学方法:如ELISA、WESTERN等,特别是对结构决定簇的抗体检验,比较真实的反映了蛋白质的折叠状态。
实例
1、MHCII JBC 269(47):1994
增溶:16-40mg Protein,8MGdnHCl,16-32mM DTT,1mM EDTA,50mM Tris pH8.037度hr.
复性:8-16fold dilution to1-5mg/ml Protein.
2、增溶:10mM DTT,0.1%SDS,25mM Tris,200mMGlucine pH8.5.
复性:10倍稀释到10mM DTT,2mMDodOMalt(dodecyl-beta-D-maltoside),150mMNaCl,10mMTris pH8.0.对起始缓冲液密闭透析16hr,开口透析8hr,对150mMNaCl,10mM Tris pH8.0透析48hr。
3、Bovine Prethrombin-2,JBC 270(1):1990 四对二硫键。
增溶:7M GdnHCl,10mMTris pH8.0,1mM EDTA 4mg/ml.
复性:稀释到100mM Na2HPO4,2 mM EDTA,0.1% PEG,0-4M GdnHCl,0.1 mM GSSG,0.2 mM GSH,pH7.4,0.025 mg/ml Protein.RT 24hr.对4L 25mM sodiumphosphate,2mM EDTA,0.1%PEG,pH7.4 透析3次,温度4度。
纯化
一般说来,复性液的体积较大,为了减少处理体积,在进行柱纯化以前可以先进行硫酸铵沉淀,沉淀在低速离心收集后复溶的盐浓度较高,可以直接进行HIC纯化,目标峰经适当稀释后(cond<5mS/cm)进行IEX纯化,然后通过SEC脱盐,更换缓冲液,除菌过滤后,在质量合格的情况下便可以进入制剂阶段。
当然在复性浓度较高的情况下,也可以直接将复性液进行IEX纯化,优点是在纯化的同时进行体积的浓缩,为以后的精制创造条件。
从生产的角度看,由于每增加一步纯化工序便降低很多收率,所以可过两到三次柱纯化,工艺越简单越有利于收率的提高。当然这只是一个般的原则,对于纯度要求较高的产品如重组人白蛋白,不得不进行多次纯化。
与蛋白质
1. 真核细胞表达外源蛋白质的缺点
一些蛋白质需要翻译后的修饰,如糖基化,则必须选用真核细胞。但是无论是正在临床的还是市场上的蛋白质药物,主要的是以大肠杆菌作为宿主细胞。
1982年第一次选用大肠杆菌作为表达重组DNA的宿主细胞,表达的产物是人胰岛素。选择原核细胞作为表达载体,因为真核细胞表达外源蛋白质有其缺点: (1)真核细胞的天然蛋白质的表达和外源蛋白质的表达,表达量相当少,即使有的蛋白质表达量高时,容易出现蛋白质的无活性的现象,或者形成聚集体;而原核细胞表达的蛋白质量比真核细胞大很多;
(2)相对于大肠杆菌,人类对于真核细胞的基因的了解还是有限的,而对大肠杆菌的基因了解的相当透彻,并能进行熟练的基因重组等操作对大肠杆菌的基因进行改造;
(3)真核细胞生长到高密度需要更长的时间(7天左右),并且细胞的最终浓度低,所以需要较大的培养容器,而大肠杆菌可以在几个h以内达到108cells/mL;
(4)动物细胞生长的培养液的造价较高,并且大部分使用血清作为生长液的添加剂,从而提高了产品的造价并且不利于以后的纯化步骤;
(5)原核细胞的坚硬的细胞壁,可以使用简单的搅拌的方法完成传热、传质过程,而大部分的真核细胞需要温和的培养方法及复杂的操作以达到其对培养基的要求 。
基于以上的原因,真核细胞尤其是哺乳动物细胞表达外源蛋白质大部分处在研究阶段,大部分重组蛋白质使用的表达载体是大肠杆菌细胞。大肠杆菌表达的外源蛋白质量相当大,有时达到细胞内蛋白质总量的5-20%,甚至达到50%以上。但是,大肠杆菌表达的蛋白质,当含量相当大时,有时由于原核细胞缺少分泌到胞外的机制或者折叠的机制,最后表达的蛋白质往往以无活性的包涵体的形式存在。
2. 包涵体表达蛋白质的优越性
为了研究基因的功能,可以把体内的基因转移到其他表达宿主中,研究基因表达性状以确定基因的功能。但是,外源基因的表达,特别是真核生物基因在大肠杆菌中的表达,由于宿主菌缺乏此种基因表达的调控机制,细胞内的化学环境与其天然环境差异,如氧化还原环境、胞内pH、自由水的浓度,以及外源基因的导入,使得表达目的蛋白质的细胞在非正常状态下生长,表达的蛋白质多数以无活性的包涵体的形式存在。
在下游生产过程中特别是在医药生产中,以包涵体形式表达的蛋白质具有一些优越性。
(1) 异源表达的蛋白质很容易被宿主细胞内的蛋白质酶降解,如果重组蛋白质以包涵体形式表达,由于包埋了酶攻击的位点,可以最大限度地抵抗蛋白质酶的攻击;
(2) 包涵体表达的蛋白质没有活性,细胞破碎和以后的纯化步骤不用考虑蛋白质的失活问题;
(3) 包涵体形式表达的蛋白质与宿主细胞的其他蛋白质的分离比可溶蛋白质的分离方法简便,造价低,使用简单的离心或者过滤的手段就能使包涵体与宿主细胞的其他蛋白质成分进行有效的分离;
(4) 有些表达的外源蛋白质对细胞有毒性或者致死,大量表达时会导致细胞的死亡,最终的细胞数量和产物相当低;而包涵体形式的蛋白质由于丧失了生物活性从而可以高效大量地表达;
(5) 对于以包涵体形式表达的产物可以比较容易进行在线观测定性,含有包涵体蛋白质的细胞有较大的折射率,不必像可溶的蛋白质需要细胞破碎后使用酶学或者电泳学的方法进行鉴定。
包涵体的形成和蛋白质在等电点或者高盐情况下的沉淀是不同的。在沉淀过程中,分子是通过分子表面的相互作用而形成的分子的聚集,无论在聚集的沉淀状态还是在天然状态,没有明显的构象的变化。因此,当溶液中的pH重新改变,或者沉淀重新溶解的时候,蛋白质的结构和活性会重新获得。蛋白质的包涵体形式的聚集则不同于蛋白质的沉淀,把包涵体蛋白质直接溶解在天然的缓冲液中得不到天然的构象,无活性的聚集体与其天然活性形式之间没有自然的平衡转化的过程。包涵体的形成是由于范氏引力、疏水作用力和二硫键等作用力形成的,破坏这些作用力比较困难,溶解包涵体需要加入强的变性剂破坏多肽链之间的作用力,说明聚集体的多肽链之间的作用力远远大于普通的沉淀的分子间的作用力。当变性剂溶解的包涵体只是简单地通过稀释或者透析除去变性剂,而不是寻找合适的复性的条件的话,聚集体会重新形成,并且,不同于沉淀溶解的100%的活性的保留,包涵体的复性水平往往很低。所以,蛋白质沉淀是活性的天然蛋白质之间的作用力形成的,而包涵体的形成是在细胞内新合成的蛋白质肽链中间体而形成的,体外折叠时的聚集体是折叠过程中折叠中间体形成的。这些折叠的中间体并不一定是形成高级天然结构的中间体,从天然结构也不能推论出折叠中间体的构象。
| ||||||||||||||||||||||||||||||||||||